Reakcióegyenletek a szerves kémiához
A szerves kémia a kémia egyik nagy tudományága, amely a szénvegyületek, azaz a szerves vegyületek szerkezetét, tulajdonságait és kémiai reakcióit tárgyalja. A kémiai reakciókat a reakcióegyenletekkel szoktuk tömören leírni, így igen sok kémiai információ adható át velük. Természetesen ez igényli azt, hogy értsük a kémia reakcióegyenletek felírásának elveit. A szerves kémia rengeteg reakcióegyenletet foglal magában, de ha egy maréknyit megismerünk, akkor átaluk egy kis betekintést nyerhetünk a szerves kémiába.
Négy tipikus kémia reakciót tárgyal a szerves kémia: a szubsztitúciót, az addíciót, a polimerizációt és az eliminációt.
Szubsztitúció
A szubsztitúció során egy szerves molekula szénatomjához kötődő ligandum (atom vagy molekularészlet) egy másik ligandumra cserélődi ki, és a reakció során a két kiindulási molekulából két megváltozott összetételű molekula jön létre. A szubsztitúciós reakció jellemző az alkánokra:
Metán szubsztitúció klórral:
CH4 + Cl2 = CH3–Cl + HCl
Az aromás vegyületekre szintén jellemző a szubsztitúció:
Benzol szubsztitúció brómmal:
C6H5–H + Br2 = C6H5–Br + HBr
Addíció
Az addícióban általában a szénatomok között többszörös kovalens kötést tartalmazó szerves molekulák vesznek részt. A kettős kötés egyszeres kötéssé (a hármas kötés kettős vagy egyszeres kötéssé) alakul át, miközben a két kiindulási molekula egyesül egymással egy terméket hozva létre. Az addíció jellemző az alkánokra, amelyek kettős kötéseket tartalmaznak:
Etén addíció klórral:
CH2=CH2 + Cl2 = Cl–CH2–CH2–Cl
Etén addíció hidrogén-kloriddal:
CH2=CH2 + HCl = CH3–CH2–Cl
Etén vízaddíció, amely egyben alkalmas az etanol előállítására:
CH2=CH2 + H2O = CH3–CH2–OH
Etén hidrogénaddíció:
CH2=CH2 + H2 = CH3–CH3
Az alkineknek szintén jellemző reakciója az addíció:
Kitűnő példa erre az acetilén vízaddíció, ahol a közvetlenül keletkező vinil-alkohol izomerizációval tovább alakul acetaldehiddé.
CHɼCH + H2O ɹ CH2=CH–OH ɹ CH3–CH=O
Markovnyikov-szabály
Az addíciókra vonatkozik a Markovnyikov-szabály. Ez alapján, ha a kettős kötésben résztvevő két szénatomhoz különböző számú hidrogén kapcsolódik, és a kettős kötést hordozó molekula egy hidrogén-halogeniddel (például hidrogén-kloriddal) vagy vízzel reagál, akkor a hidrogén-halogenid vagy víz hidrogénatomja az elve több hidrogénatomot tartalmazó szénatomhoz fog csatlakozni, amíg a halogénatom vagy hidroxil-csoport értelemszerűen a kevesebb hidrogénatomot tartalmazóhoz:
Propén addíció hidrogén-kloriddal:
CH3–CH=CH2 + HCl = CH3–CHCl–CH3
A konjugált kettős kötéseket tartalmazó molekulák addíciója különleges, mivel a konjugált kettős kötésrendszer delokalizálódik, így több részlegesen vagy teljesen telített molekulának az elegye jön létre:
Izoprén bróm addíció:
CH2=C(CH3)–CH=CH2 + Br2 ɹ CH2Br–C(CH3)Br–CH=CH2, CH2=C(CH3)–CHBr–CH2Br, CH2Br–C(CH3)=CH–CH2Br, CH2Br–C(CH3)Br–CHBr–CH2Br
Polimerizáció
A polimerizáció során kis méretű molekulák kapcsolódnak össze nagy számban, kémiailag azonos módon nagy méretű molekulákat, úgynevezett polimereket, létrehozva. A szénhidrogének vagy halogénezett szénhidrogének között a kettős kötéseket hordozó molekuláknál tipikus a polimerizáció. Számos műanyag szintézise jó példa ezekre a reakciókra:
Etén polimerizációja, amelynek a terméke a polietilén:
n CH2=CH2 = (–CH2–CH2–)n
Propén polimerizációja, amelynek a terméke a polipropilén:
n CH2=CH–CH3 = (–CH2–CH(CH3)–)n
Izoprén polimerizációja, amely a természetben is végbe mehet, poliizoprént, azaz gumit hozva létre:
n CH2=C(CH3)–CH=CH2 = (–CH2–C(CH3)=CH–CH2–)n
Sztirol polimerizációja, aminek a terméke a polisztirol:
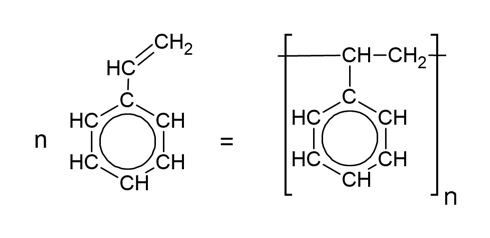
Vinil-klorid polimerizációja, amelynek a terméke a PVC (polivinil-klorid):
n CH2=CH–Cl = (–CH2–CHCl–)n
Elimináció
Az elimináció során egy szerves molekulának két egyszeres kötéssel összekapcsolt szénatomjáról fog egy-egy ligandum távozni, és a két szénatom között kettős kötés fog kialakulni. Az elimináció például a halogénezett alkánok tipikus reakciója:
CH3–CH2–Br + NaOH = CH2=CH2 + NaBr + H2O
Más ligandumok is részt vehetnek eliminációs reakcióban. Jó példa erre az etanol eliminációja, amelyet etén előállításra használnak fel:
CH3–CH2–OH = CH2=CH2 + H2O
Az eliminációkra vonatkozik a Zajcev-szabály, amely kimondja, hogy ha a kettős kötés kialakulhat több, különböző számú hidrogénatomhoz kapcsolódó szénatomon is egy hidrogénatom távozásával, akkor arról a szénatomról fog távozni a hidrogénatom, ahol eleve kevesebb hidrogénatom volt:
CH3–CHBr–CH2– CH3 + NaOH = CH3–CH=CH–CH3 + NaBr + H2O
Más fontos szerves kémiai reakciók
A négy jellemző szerves kémiai reakciótípuson kívül természetesen rengeteg más szerves kémiai reakció létezik. Ezek közül mutatunk be néhányat, amelyek valamilyen általános elvet tükröznek, egy szerves vegyületcsalád jellemző tulajdonságát mutatják be vagy fontos szerves molekulákhoz köthetőek.
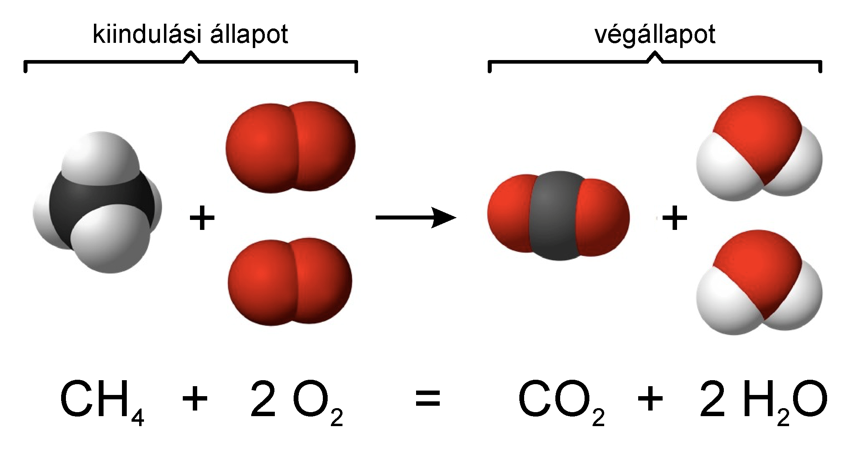
Tökéletes égés
Tökéletes égésnek a szénhidrogénekre vonatkozó általános egyenletét gyakran szoktuk kémiai számításokban felhasználni:
CxHy + (x+y/4) O2 = x CO2 + y/2 H2O
Amennyiben a hidrogénen és szénen kívül más elemet is tartalmaz a szerves molekula, a tökéletes égés egyenlete módosulni fog. Például az etanol égését az alábbi reakcióegyenlettel írhatjuk le:
CH3–CH2–OH + 3 O2 = 2 CO2 + 3 H2O
Sav-bázis reakciók
Két szerves vegyületcsalád tagjainak a vizes oldatai kémhatása jellemzően eltér a semlegestől. A karbonsavak savas kémhatásúak, amire az ecetsav disszociációja jól példáz:
R–COOH = R–COO– + H+
Az aminok meg lúgos kémhatásúak, amire jó példa a metil-amin reakciója a vízzel:
CH3–NH2 + H2O Ý CH3–NHœ + OH–
Redoxireakciók
Az oxigéntartalmú szerves vegyületcsaládok tagjai redoxireakciókkal át tudnak egymásba alakulni. Például az etanolból acetaldehid keletkezik oxidációval, fordítva meg acetaldehidből etanol redukcióval.
Etanol oxidáció:
CH3–CH2–OH + CuO = CH3–CH2=O + Cu + H2O
Acetaldehid redukció:
CH3–CH2=O + H2 = CH3–CH2–OH
Ezüsttükörpróba
Az aldehidek ketonoktól való megkülönböztetésére két igen híres reakciót is alkalmaznak. Az egyik az ezüsttükörpróba, amelyben ezüst-nitrátot, ammónium-hidroxidot és némi nátrium-hidroxidot tartalmazó reagenst használnak. A reakció során ezüst válhat ki a kémcső falára, innen származik a reakció elnevezése.
Acetaldehid ezüsttükörpróba:
CH3–CH=O + 2 [Ag(NH3)2OH] = CH3–COOH + 2 Ag + 2 NH3 + H2O
Fehling-próba
A másik kimutatásra használt reakció a Fehling-próba, amelyhez réz(II)-szulfát oldatot és nátrium-hidroxiddal erősen lúgosított kálium-nátrium-tartarát oldatot kevernek össze frissen, majd adnak a tesztelni kívánt anyag oldatához. A pozitív próbát a réz(I)-oxid vörös színe jelzi.
Acetaldehid Fehling-próbája:
CH3–CH=O + 2 Cu2+ + 4 OH– = R–COOH + Cu2O + 2 H2O
Egyensúlyi reakciók
A legközismertebb egyensúlyi reakció a szerves kémiában az etil-acetát észter előállítása:
CH3–COOH + CH3–CH2–OH Ý CH3–CO–O– CH2–CH3 + H2O
Fő- és mellékreakció
Sok kémiai reakció során nem csak a preferált reakció megy végbe valós körülmények között, hanem mellékreakció is történik. Az emelt szintű kémia érettségire a metán hőbontását kell tudni erre a jelenségre példaként, amit az acetilén ipari előállítására használnak. A metán hőbontásának mellékreakciója során szén keletkezik melléktermékként.
Metán hőbontás főreakció:
2 CH4 = CHɼCH + 3 H2
Metán hőbontás mellékreakció:
CH4 = C + 2 H2
Ha a kémia érettségire készülsz, és valamit nem értettél a fenti szövegből, akkor érdemes lehet csatlakoznod valamilyen kémia érettségi felkészítőhöz, ahol részletesen elmagyaráznak mindent, amit tudnod kell a kémia érettségire. Ha mindent értettél vagy tudsz, de kíváncsi vagy az összes szerves kémia reakcióegyenletre, amit az érettségiken kérdeznek, akkor ezeket le tudod tölteni a Budapesti Reáltanoda tanulócsoportjából: